MSGC-5413D
Target: CD4
Т-клеточный иммунитет является ключом к иммунным реакциям против опухолей. Традиционно эта функция была приписана CD8 Т-лимфоцитам с цитотоксической активностью. В последние годы осознание того, что CD4 T-клетки также играют важную роль в защитных противоопухолевых реакциях, получает все большее внимания.
Молекула MSGC-5413D агонист CD4 (агонист — химическое соединение, которое увеличивает активность рецептора). CD4 Т-клетки способны распознавать опухолевые антигены, представленные на поверхности опухолевых клеток в ассоциации с молекулами МНС класса II. Экспрессируются на тимоцитах (80-90 %), зрелых T-лимфоцитах (65 % Т-хелперов), моноцитах, макрофагах, клетках Лангерганса, дендритных клетках. CD4 участвует также в передаче в клетку активационного сигнала. В непосредственном контакте с CD4 находится молекула тирозинкиназы p56- lck, которая создает комплекс с CD4. Через молекулу CD4 в опухолевую или клетку инфицированную вирусом, передается сигнал вызывающий их гибель путем апоптоза.
CD4 MOLECULE
CD4 — гликопротеин, присутствует на Т-хелперах, моноцитах, макрофагах и дендритных клетках. CD4 является рецептором для молекул МНС класса II. CD4 участвует в передаче в клетку активационного сигнала. В непосредственном контакте с CD4 находится молекула тирозинкиназы p56-Lck. Активирует Т-киллеры, В-лимфоциты, моноциты, NK-клетки, а также продуцирует цитокины.
Более подробно на рисунке:
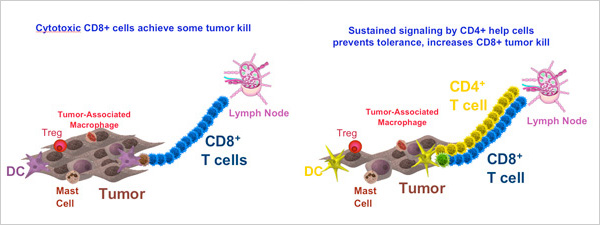
Слева на рисунке показано, что иммунные клетки CD8 перемещаются из лимфатического узла и пытаются убить опухолевые клетки. Но цитотоксический эффект носит ограниченный характер и опухоль в большинстве случаев остается неповрежденной (Ostrand-Rosenberg, Cancer Invest. 2005).
Справа на рисунке - молекула MSGC-5413D увеличивает число клеток устойчиво экспрессирующих CD4, что стимулирует другие иммунные клетки присоединяться к атаке CD8 на опухоль. В этом случае, цитотоксический потенциал CD8 клеток возрастает в сотни раз и опухоль будет эффективно разрушена.
Низкий уровень CD4
- CD4 снижается при химиотерапии, лучевой терапии.
- Низкий уровень CD4 нарушение активации лимфоцитов и выработки цитокинов.
- Прогрессирование опухолевого процесса.
- Нарушения распознования опухолевых антигенов.
Молекула MSGC-5413D восстановление экспрессии CD4
Молекула MSGC-5413D фосфорилирует тирозинкиназу p56-lck, что способствует активации цитотоксических клеток, повышает продуцирование важных активационных цитокинов IL-2, IFN гамма. Кроме того, MSGC-5413D препятствует апоптической гибели Т-клеток, индуцированной химиолучевой терапией, а также опухолью.
MSGC-5413D нормализует количество CD4 клеток. Это необходимо, чтобы презентирующие DC (дендритные клетки) передали сигнал об опухолевом антигене. MSGC-5413D фосфорилирует тирозинкиназу p56-Lck, что приводит:
- Активации CTL (цитотоксичных лимфоцитов способных убивать опухолевые клетки).
- Увеличению продуцирования цитокинов IL-2, IFN-γ.
- Мобилизации антигенпрезентации опухолевых антигенов (усиление способности распознавать опухолевые белки иммунной системой организма пациента).
-
Отсутствие «помощи» со стороны CD4 T-клеток, приводит к усилению регуляции ингибирующих рецепторов на цитотоксических клетках иммунитета (Tomasz Ahrends, 2018). А это означает, что цитотоксические CD8 T-клетки, присутствующие в крови пациентов с раком, экспрессируют PD-1 (белок «иммунный тормоз»). Следовательно, циркулирующие PD-1 положительные CD8 T-клетки у онкологических пациентов могут представлять «беспомощный» фенотип, поскольку такие иммунные клетки не способны атаковать опухоль.
Аналоги
Zanolizumab,
Tregalizumab,
Ibalizumab (также известны под торговыми названиями - Hu5A8, IBA, TMB-355, TNX-355)
Стоимость от 34500 до 72300 долларов.Польза для пациента
1. Молекула Меркурида (MSGC-5413D) увеличивает число клеток устойчиво экспрессирующих CD4, что стимулирует другие иммунные клетки присоединяться к атаке CD8 на опухоль. В этом случае, цитотоксический потенциал CD8 клеток возрастает в сотни раз и опухоль будет эффективно разрушена.2. Отсутствие адекватного количества CD4 T-клеток, приводит к усилению регуляции ингибирующих рецепторов на цитотоксических клетках иммунитета (Tomasz Ahrends, 2018). А это означает, что цитотоксические CD8 T-клетки, присутствующие в крови пациентов с раком, экспрессируют PD-1 (белок «иммунный тормоз»).
Следовательно, циркулирующие в организме пациента CD8 T-клетки, положительные по PD-1, представляют абсолютно бесполезный и беспомощный фенотип, поскольку такие иммунные клетки не способны атаковать опухоль.
Таким образом, стратегия иммунотерапии, направленная на оптимальное увеличение CD4 T-клеток может повысить эффективность immune checkpoint inhibitors.3. CD4 клетки эффективно лизируют (уничтожают) опухолевые клетки, покрытые антителами IgG. Экспрессируя FcγRI и его сигнальную цепь в CD4 Т-клетках, мы успешно использовали этот механизм для лечения рака. Этот механизм имеет название - антителозависимая клеточно-опосредованная цитотоксичность (ADCC), т.е нормализуя выработку защитные IgG-антител, которые опсонируют (покрывают, обволакивают) поверхность опухолевой клетки, что привлекает к ним CD4 клетки, которые вызывают гибель опухоли.
Роль CD4 + T-клеток в противоопухолевом ответе заключается в экспрессии неоантигенов MHC-II опухоли.
Активация CD4 + T-клеток необходима для прайминга (от англ., Priming - первый контакт Т-клетки со своим специфическим антигеном и необходим для её дифференцировке в цитотоксическую клетку, т.е. способную убивать) CD8 + T-клеток, что являются критически важным моментом для эффективной противоопухолевой иммунотерапии.
Применение Меркурида для мультитаргетной иммунотерапии позволяет нам реализовать три механизма гибели опухолевых клеток.
Литература
1. Foti M, Phelouzat MA, Holm A, Rasmusson BJ, Carpentier JL (February 2002). "p56Lck anchors CD4 to distinct microdomains on microvilli". Proc. Natl. Acad. Sci. U.S.A. 99 (4): 2008–13.
2. Donia, M. et al., 2015. Aberrant expression of MHC Class II in melanoma attracts inflammatory tumor specific CD4+ T cells which dampen CD8+ T cell antitumor reactivity. Cancer Res 75(18):3747-59
3. Dunn, Gavin P., Old, Lloyd J. and Schreiber, Robert D., 2004. The immunobiology of cancer immunosurveillance and immunoediting. Immunity 21:2, pp. 137–148
4. Qin, Z and Blankenstein, T., 2000. CD4+ T cell-mediated tumor rejection involves inhibition of angiogenesis that is dependent on IFNγ receptor expression on nonhematopoietic cells. Immunity 12:6, pp. 677–686
