MMC-5136C
Target: TNFα
Молекула MMC-5136C для ингибирования активности провоспалительного цитокина TNFα. На тему (TNF) в PubMed опубликовано около 50 000 статей. Это демонстрирует огромный научный и клинический интерес к молекуле. TNF провоспалительный цитокин паракринного и аутокринного действия. Стимулирует активность генов, ответственных за развитие и хронизацию воспаления. Индуцирует продукцию медиаторов воспаления, молекул адгезии и апоптоз клеток. Влияет на липидный метаболизм, устойчивость к инсулину, атерогенез, развитие фиброза. Избыточная продукция TNF вызывает расстройства гемодинамики (снижает сократимость миокарда, минутный объем крови), оказывает апоптический эффект на кардиомиоциты и эндотелиоциты. Повышенные уровни TNF обнаруживают в синовиальной жидкости у больных ревматоидным артритом, псориатическим артритом. TNF участвует в развитии патологического воспаления и разрушения суставной ткани. В опухолевом генезе, гиперпродукция TNFα, способствует выживанию генетически измененных опухолевых клеток, инвазии и метастазированию. Источником TNFα являются как сами опухолевые клетки, так и клетки самого пациента, число которых увеличивается по мере прогрессирования опухоли, потому что организм все больше использует воспалительный тип иммунного ответа на новообразование.
TNFα cytokine
TNFα — цитокин, регулирует процессы: апоптоза, некроза, стимулирование пролиферации опухолевых клеток, образование сосудов в зоне опухолевого роста
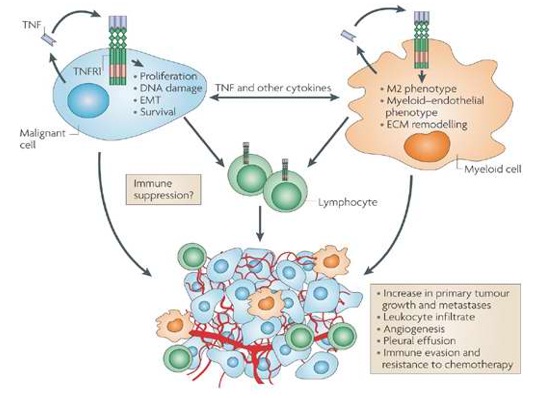
Высокий уровень TNFα способствует:
- Выживанию опухолевых клеток через индукцию генов, кодирующих NF-kB-зависимые противоапоптозные молекулы (Shishodia и Aggarwal, 2004).
- Усилению ангиогенеза опухоли через белки VEGF и jagged-1 (Johnston et al, 2009)
- Увеличению выработки металлопротеиназ (MMPs), что приводит к shedding (слущиванию рецепторов с поверхности лимфоцитов) и нарушению иммунных функций (Hagemann др, 2005)
MMC-5136C уменьшает гиперпродукцию TNFα
Молекула MMC-5136C снижает повышенный уровень TNFα, специфически блокируя TNF-α индуцированную пролиферацию клеток, малигнизацию, инвазию (прорастание опухоли в соседние ткани). Это позволяет:
1. Препятствовать опухолевому ангиогенезу (росту новых сосудов опухоли).
2. Уменьшить выработку металлопротеиназ (MMPs), это особых класс ферментов запускающих деградацию коллагена IV, ламининов — компонентов базальной мембраны, что является необходимой предпосылкой для активного роста новых сосудов опухоли и активации метастаз.
3. Ограничить инвазию (прорастание) опухолевых клеток.
4. Уменьшить активность противоапоптозных белков Bcl-2 (англ. Apoptosis regulator Bcl-2) — внутриклеточный белковый фактор, который препятствует апоптозу (клеточной гибели) опухолевых клеток. В результате, опухолевые клетки погибают точечно, путем апоптоза (самоуничтожения). Здоровые клетки - не повреждаются.
Аналоги
Infliximab (инфликсимаб),
Adalimumab (адалимумаб),
Certolizumab pegol (цертолизимаб-пеголь, кимзия, цимзия, симзия).
Стоимость курса лечения этими препаратами 10000 – 12000 долларов за курс.
Конкурентные преимущества MMC-5136C
В отличии от аналогов, молекула MMC-5136C создана с уникальными стереохимическими параметрами, что позволяет ей действовать на двух уровнях:
На надклеточном уровне, изменяет конформацию белков-рецепторов к TNFα, чем препятствует транслокации NF-kB (ядерного фактора каппа В) в ДНК клетки и останавливая активацию порядка 300 генов, ответственных за развитие рака.
Внутри клетки, конкурирует за фосфатные группы ингибирует фосфорилирование р38-MAPK signaling pathway, снижая активность генов, ответственных за гиперпродукцию TNFα.
Другими словами, молекула устраняет не только симптом, но и саму причину гиперэкспрессии TNFα.
Литература
1. Old LJ (1988) Tumor necrosis factor. Sci. Am. 258: 59–75
2. Wajant H, Henkler F, Scheurich P (2001) The TNF-receptor-associated factor family. Scaffold molecules for cytokine receptors, kinases and their regulators. Cell Signal. 13: 389–400
3. Hsu H, Shu HB, Pan MG and Goeddel DV (1996) TRADD-TRAF2 and TRADD-FADD interactions define two distinct TNF receptor 1 signal transduction pathways. Cell 84: 299–308
4. Devin A, Cook A, Lin Y et al. (2000) The distinct roles of TRAF2 and RIP in IKK activation by TNF-R1: TRAF2 recruits IKK to TNF-R1 while RIP mediates IKK activation. Immunity 12: 419–429
5. Yang J, Lin Y, Guo Z et al. (2001) The essential role of MEKK3 in TNF-induced NF-kappa B activation. Nat. Immunol. 2: 620–624
6. Marino MW, Dunn A, Grail D et al. (1997) Characterization of tumor necrosis factor-deficient mice. Proc. Natl. Acad. Sci. USA 94: 8093–8098
